Les noyaux au cœur de la mémoire musculaire ?
Environ 2500 mots - Temps de lecture estimé : 12 minutes.
Dans cet article, nous allons évoquer les mécanismes à l’origine de la mémoire musculaire, c’est-à-dire la capacité du muscle à retrouver rapidement des niveaux de force et d’hypertrophie déjà atteints par le passé. On entend souvent que ce phénomène est lié à la conservation de nouveaux noyaux acquis par la fibre musculaire lors de la phase d’entraînement initiale. Mais qu’en est-il vraiment ? Nous allons essayer de fournir une réponse tout en apportant quelques précisions importantes.
Points clés




Si vous pratiquez la musculation ou la force athlétique depuis un certain temps, il y a de fortes chances que vous ayez été ou soyez prochainement confronté à une période d’arrêt prolongé de l’entraînement. Qu’il s’agisse de contraintes professionnelles, matérielles ou d’un évènement quelconque de la vie, cela peut se présenter et parfois vous n’aurez pas d’autres solutions que de mettre entre parenthèse votre pratique sportive. Mais lorsque vient le temps de la reprise naît alors l’inquiétude. Où en suis-je ? Quelles seront mes performances et surtout combien de temps me faudra-t-il pour retrouver le niveau pour lequel j’avais fourni tant d’effort. Heureusement pour vous, un pratiquant plus expérimenté viendra vous rassurer en vous expliquant qu’il n’y a pas lieu de s’inquiéter et que grâce à la mémoire musculaire, vous retrouverez vos performances et votre masse musculaire en moins de temps qu’il ne vous en a fallu pour les obtenir en premier lieu.
La littérature scientifique elle-même supporte le fait qu’il est plus rapide d’atteindre des niveaux de masse musculaire et de performance déjà acquis avant une période de désentraînement que de créer ces adaptations pour la première fois (1,3). La « mémoire musculaire » désigne ainsi la capacité du tissu musculaire à rappeler rapidement les adaptations qu’il avait préalablement acquises lorsqu’il est à nouveau soumis aux stimuli qui les avait déclenchés.
Mais quels sont les mécanismes à l’origine de cette capacité ? Si le pratiquant expérimenté qui vous a rassuré parcourt les forums, les articles de site spécialisés ou s’il s’est aventuré dans quelques publications scientifiques, il vous soutiendra probablement que la mémoire musculaire s’explique par le fait que lors du processus d’hypertrophie déclenché par l’entraînement, les fibres musculaires acquièrent de nouveaux noyaux. Ainsi, lors de la période d’arrêt, tandis que les fibres musculaires perdent du volume, la quantité de noyaux, quant à elle, resterait stable. C’est cette permanence des noyaux qui permettrait au muscle lors de la reprise de se « réhypertrophier » plus rapidement que le muscle naïf.
Si vous avez quelques connaissances en physiologie du muscle squelettique, cette explication vous paraîtra sans doute acceptable. Mais qu’en est-il vraiment ?
La fibre musculaire : une cellule multinucléée
Pour mieux comprendre cette théorie, il semble important de revenir aux bases de la structure d’un muscle strié squelettique. Chaque groupe musculaire est composé d’un ou plusieurs chefs. Chacun de ces chefs contient plusieurs paquets de fibres musculaires enveloppés dans du tissu conjonctif (figure 1). Une fibre musculaire est une cellule unique qui contient de nombreuses sous-unités contractiles appelées myofibrilles. La cellule musculaire s’étend ainsi d’une insertion musculaire à l’autre et parcourt le chef musculaire sur toute sa longueur.
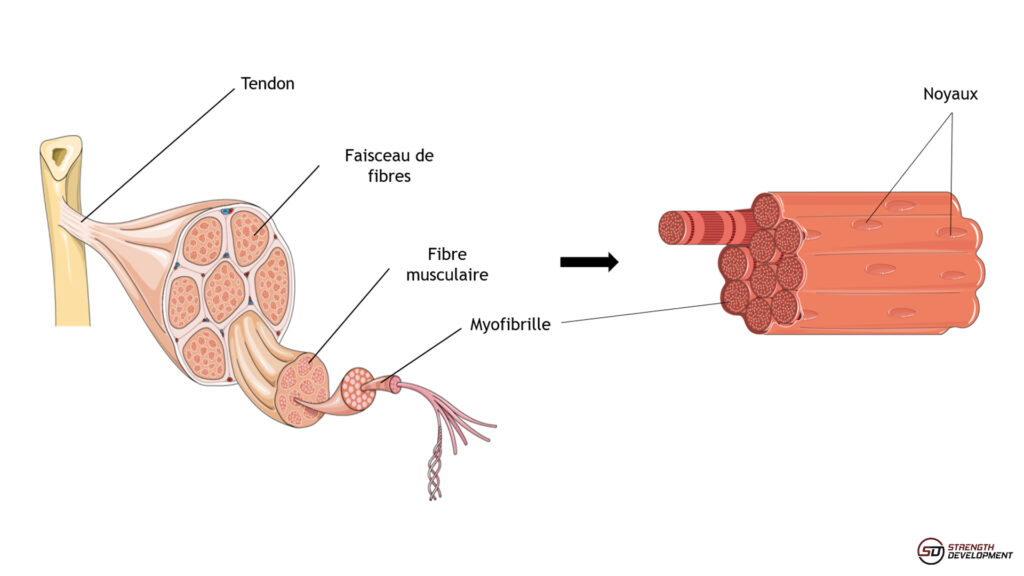
Figure 1. Représentation schématique d’un muscle strié squelettique. Les fibres musculaires sont des cellules uniques possédant de nombreux noyaux localisés en périphérie.
Elle est issue de la fusion de nombreuses cellules progénitrices, apportant chacun leur noyau et lui conférant sa spécificité de cellule multinucléée. Chacun de ces noyaux contient l’information génétique, identique aux autre cellules du même organisme, qui permet la synthèse des ARNs et des protéines nécessaires au fonctionnement de la cellule. Dans une fibre saine et mature, ces noyaux sont localisés en périphérie, au niveau du sarcoplasme (la membrane de la fibre musculaire). Ils sont répartis tout le long de la cellule, d’où le concept de domaine myonucléaire, selon lequel chaque noyau serait en charge d’un volume cellulaire donné. Par exemple, la fibre musculaire d’un biceps d’adulte contient environ 300 noyaux/cm (4) !
Dénombrer les noyaux dans une fibre musculaire
Deux méthodes sont principalement utilisées pour quantifier les noyaux dans les fibres musculaires (4,5). La technique la plus courante pour étudier le muscle dans des modèles animaux (souris et rat le plus souvent) consiste à prélever le muscle entier et à le congeler de façon à réaliser des coupes transversales très fines (figure 2).
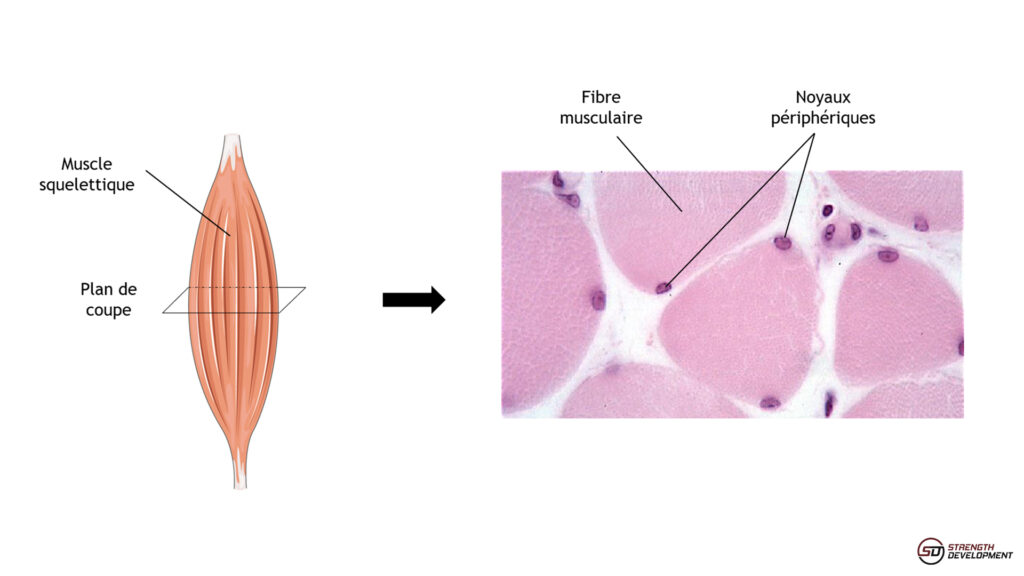
Figure 2. La coupe histologique transversale d’un muscle permet de mesurer la surface des fibres et de compter les noyaux présents dans le plan de coupe. Ici, la coloration hémalun – éosine permet de les distinguer en microscopie (lumière blanche).
On peut alors marquer spécifiquement certaines protéines des fibres grâce à des anticorps couplés à des molécules fluorescentes. Traditionnellement, on peut cibler la laminine qui est une protéine du tissu conjonctif, et qui permet donc de distinguer les fibres dans la coupe. On peut ainsi déterminer la surface des fibres pour étudier l’hypertrophie ou l’atrophie. Simultanément, il est possible de marquer spécifiquement les noyaux avec des molécules qui s’intercalent dans l’ADN comme le DAPI. Idéalement, il est possible d’utiliser un anticorps ciblant spécifiquement les noyaux des fibres ce qui permet de les différencier des noyaux des cellules souches musculaires. La figure 3 montre une coupe transversale de muscle de souris dans laquelle on observe le contour des fibres et les noyaux marqués en bleu. Il suffit alors de quantifier le nombre moyen de noyaux par fibre. Bien évidemment, comme on coupe les fibres transversalement à une longueur donnée, le nombre de noyau observable dans une fibre n’est pas forcément représentatif de la quantité de noyaux présents dans cette fibre. En effet, on peut très bien couper une fibre qui contient beaucoup de noyaux à un niveau où il n’y en a pas et inversement. Malgré tout, plus les fibres contiennent de noyaux et plus on a de chances d’en dénombrer beaucoup sur la coupe, et plus le nombre de fibres quantifiées est important, plus on a de chance d’obtenir un résultat proche de la réalité. Heureusement, chaque muscle contenant plusieurs milliers de fibres, on peut avoir confiance dans le résultat. C’est donc une méthode peu fiable à l’échelle de la fibre mais robuste à l’échelle du muscle entier.

Figure 3. Coupe transversale d’un plantaris de souris. Le contour des fibres est visible grâce au marquage de la dystrophine et les noyaux marqués par le DAPI apparaissent en bleu au microscope à fluorescence. Figure issue de Murach et al., 2020.
La seconde méthode consiste à isoler un petit nombre de fibres à partir du muscle entier et à en marquer les noyaux (figure 4). On quantifie alors le nombre de noyaux dans cette fibre ou dans une section donnée et on obtient un nombre de noyaux par unité de longueur. Cette méthode donne un résultat plus fiable par fibre étudiée mais limite le nombre de fibres quantifiées par muscle car elle exige beaucoup de travail par fibre, ce qui peut entraîner un biais de sélection des fibres. Les deux méthodes aboutissent généralement à des résultats sensiblement similaires. Les équipes de recherche choisissent leur approche ou combinent les deux. En ce qui concerne la quantification des noyaux musculaires chez l’homme, les méthodes sont les mêmes. Mais au lieu de travailler sur un muscle entier, on travaille sur un prélèvement (biopsie) de quelques milligrammes !
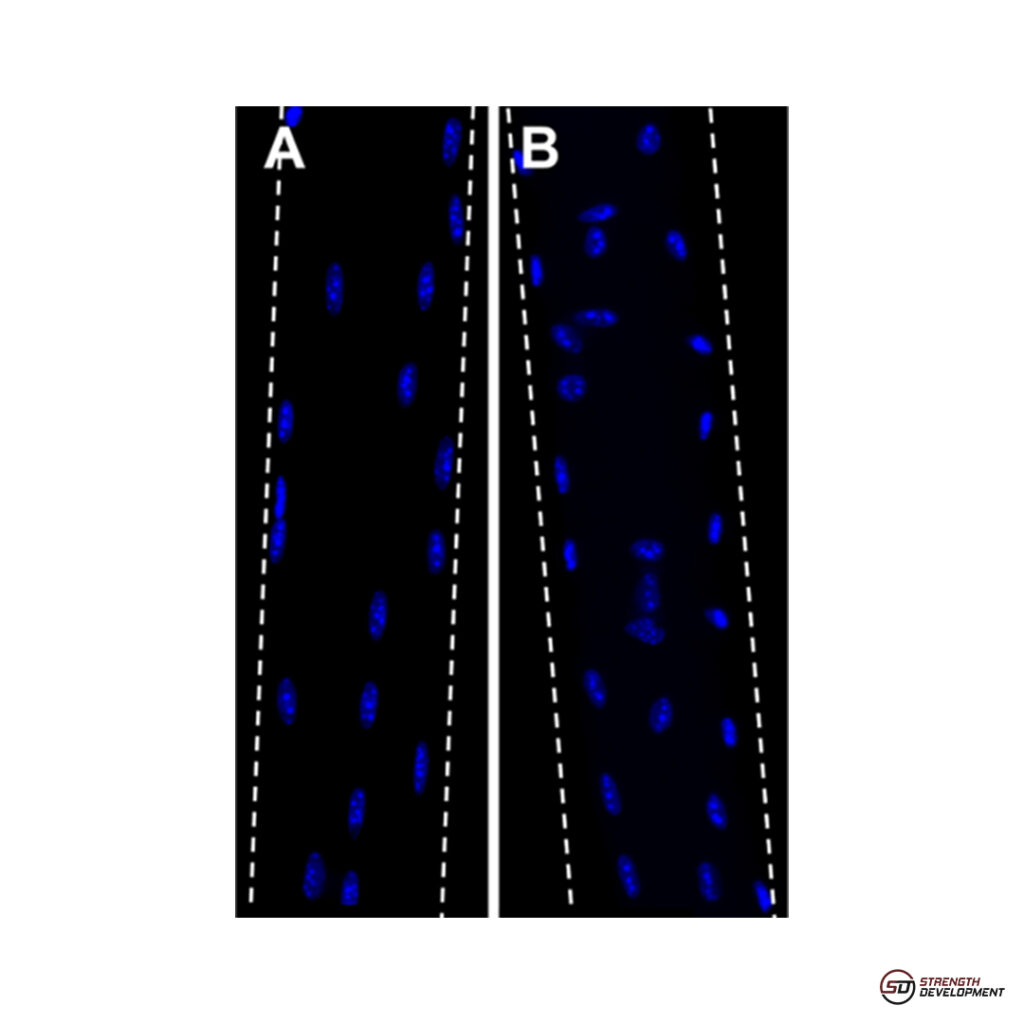
Figure 4. Marquage des noyaux dans des fibres musculaires isolées de gastrocnemius de souris. Figure issue de Murach et al., 2020.
Hypertrophie et nombre de noyaux
La théorie de la permanence des noyaux acquis suppose déjà que l’entraînement et l’hypertrophie qui en découle s’accompagne effectivement d’une augmentation du nombre de noyaux dans les fibres musculaires. Ce prérequis est validé par la littérature scientifique et la méta-analyse sur laquelle nous reviendrons dans la suite de notre réflexion supporte l’idée que l’hypertrophie des fibres s’accompagne d’une accumulation de noyaux aussi bien chez la souris que l’homme (4,6).
Ces noyaux proviennent de la fusion de cellules souches musculaires, aussi appelées cellules satellites. Ces cellules qui résident en périphérie de la fibre, s’activent en réponse aux dommages cellulaires causés par l’entrainement et sont capables de migrer vers les sites de lésion puis de fusionner avec la fibre préexistante à laquelle elles apportent leur noyau. Cette information génétique supplémentaire permettrait de subvenir aux besoins accrus de la fibre en terme de synthèse de protéines pour permettre la réparation des lésions et l’hypertrophie. Toutefois, l’apport de nouveaux noyaux n’est pas le seul mécanisme de réparation de la fibre musculaire. Un article récent montre que suite à une lésion de la membrane, les noyaux déjà présents dans la fibre migrent vers la blessure pour y délivrer des ARN messagers en grande quantité et synthétiser localement les protéines nécessaires à la reconstruction des membranes et du matériel contractile (7).
Les noyaux seraient finalement les usines mobiles de la fibre. Il a d’ailleurs été montré que des souris dépourvues de cellules souches musculaires (par approche génétique) conservaient leur masse musculaire et démontraient une hypertrophie similaire à des souris sauvages suite à un protocole d’entrainement. Ces données mettent en évidence la capacité de réparation autonome de la fibre musculaire. Il semble toutefois que lorsque ces animaux sont soumis à des protocoles d’entrainement plus longs et plus agressifs, ils ne soient pas en mesure de créer les mêmes adaptations que les souris sauvages, témoignant d’une limite d’autonomie de la fibre musculaire (8).
Ces résultats supportent la notion que chaque noyau ne peut subvenir qu’aux besoins d’un volume cellulaire fini, au-delà duquel l’apport de nouveaux noyaux est nécessaire pour l’hypertrophie de la fibre. Ainsi, chez l’individu sain, la réparation autonome et la fusion de cellules satellites sont deux mécanismes concomitants permettant l’augmentation de la masse musculaire.
Les noyaux sont-ils éternels ?
La fibre hypertrophiée accumule donc des noyaux. Mais les conserve-t-elle lorsqu’elle s’atrophie. En 2012, Bruusgaard et al., publient un article dans lequel ils montrent que l’atrophie causée par 14 jours d’immobilisation chez le rat n’induit pas de perte significative de noyaux (9). Ce résultat vient contredire la théorie alors répandue qui prédisait un domaine myonucléaire constant, c’est-à-dire un gain de noyaux lors de l’hypertrophie et une perte équivalente au cours de l’atrophie.
Le débat est toujours d’actualité, notamment parce qu’il existe une multitude de modèle d’études autour de la question. Il est possible de quantifier la perte de noyaux dans des modèle d’atrophie aigus comme la dénervation, l’immobilisation, la section de la moelle épinière, la cachexie cancéreuse ou encore le vol spatial. On peut aussi s’intéresser à l’atrophie à plus long terme comme dans le cadre du vieillissement. Pour élucider la question de la mémoire musculaire, on peut se placer dans un contexte d’entraînement, aux modalités variées, suivi d’une période de repos de durée variable ou même avoir recours à un modèle d’atrophie aigu. La diversité des modèles et l’incertitude inhérente à la mesure de ce paramètre physiologique ont donné lieu à une littérature aussi fournie qu’incapable d’apporter une réponse claire à la question.
L’autre obstacle à une conclusion définitive provient des résultats conflictuels entre les études menées sur le rongeur et celles sur l’Homme. Dans l’unique méta-analyse sur le sujet publiée récemment, les auteurs ont compilé les résultats de 147 publications dont 62 sur l’être humain (6). Ils ont divisé leur analyse en 3 catégories pour chaque modèle d’étude : effet de l’hypertrophie, effet de l’atrophie et effet du vieillissement. Pour les études humaines, les résultats sont sans appel et montrent une diminution du contenu en noyaux dans les modèles d’atrophie et les modèles de désentraînement. Les sujets âgés possèdent également moins de noyaux que les sujets jeunes. Chez le rongeur, les résultats sont plus contrastés. Les études s’intéressant à l’effet du désentraînement démontrent une rétention au moins partielle des noyaux acquis, mais sont très peu nombreuses. Les modèles d’atrophie vont dans le sens d’une diminution des noyaux mais les analyses de sous-groupes indiquent que le résultat pourrait dépendre du muscle et du contexte d’atrophie étudiés.
Discussion
Vous l’aurez bien compris, apporter une réponse définitive n’est pas possible au regard des données scientifiques disponibles. Toutefois, comme l’ont souligné successivement les revues de Snjiders et Rahmati il est évident que 1) les noyaux ne sont pas éternels et que 2) la conservation des noyaux acquis au cours de l’entraînement ne soit pas le mécanisme principal justifiant la mémoire musculaire (4,6). De plus, il est important de mentionner que la plasticité démontrée par les rongeurs soumis aux modèles d’hypertrophie et d’atrophie est bien supérieure à celle observée dans les études humaines. Ils gagnent et perdent plus de masse musculaire, plus rapidement que nous. Il n’est pas impossible cependant, en ligne avec les résultats chez l’animal, que la quantité de noyaux décline plus lentement que le volume des fibres, qui plus est dans un contexte d’atrophie accéléré comme l’immobilisation. D’ailleurs les mécanismes sous-jacents à l’élimination des noyaux sont très mal caractérisés.
On pourrait donc retenir qu’à l’image des autres adaptations induites par l’entraînement, la quantité de noyaux revient progressivement à sa valeur basale au cours d’une période de désentraînement, même si la cinétique n’est pas forcément identique à celle de l’atrophie. Si toutefois une préservation partielle des noyaux peut théoriquement contribuer à une réadaptation plus rapide lors de la reprise de l’entraînement, d’autres mécanismes comme les modifications épigénétiques qui remodèlent la structure de l’ADN ou la persistance d’adaptations neuro-musculaires sont probablement prédominants.
Bien que la science n’ait pas encore toutes les réponses et que l’on ne puisse pas compter sur nos noyaux pour nous sauver après plusieurs mois d’arrêt, cela ne nous empêche pas de planifier au mieux notre reprise pour éviter les écueils de cette phase compliquée. Nous aborderons dans un prochain article les stratégies de planification que l’on peut mettre en place pour revenir rapidement à son meilleur niveau dans de bonnes conditions.
Références
- Staron, R. S. et al. Strength and skeletal muscle adaptations in heavy-resistance-trained women after detraining and retraining. J. Appl. Physiol. 70, 631–640 (1991).
- Taaffe, D. R. & Marcus, R. Dynamic muscle strength alterations to detraining and retraining in elderly men. Clin. Physiol. 17, 311–324 (1997).
- Seaborne, R. A. et al. Human Skeletal Muscle Possesses an Epigenetic Memory of Hypertrophy. Sci. Rep. 8, 1–17 (2018).
- Snijders, T. et al. The concept of skeletal muscle memory: Evidence from animal and human studies. Acta Physiol. 229, 1–20 (2020).
- Murach, K. A. et al. Muscle memory: myonuclear accretion, maintenance, morphology, and miRNA levels with training and detraining in adult mice. J. Cachexia. Sarcopenia Muscle 11, 1705–1722 (2020).
- Rahmati, M., McCarthy, J. J. & Malakoutinia, F. Myonuclear permanence in skeletal muscle memory: a systematic review and meta-analysis of human and animal studies. J. Cachexia. Sarcopenia Muscle 2276–2297 (2022).
- Roman, W. et al. Muscle repair after physiological damage relies on nuclear migration for cellular reconstruction. Science (80-. ). 359, 355–359 (2021).
- Murach, K. A., Fry, C. S., Dupont-Versteegden, E. E., McCarthy, J. J. & Peterson, C. A. Fusion and beyond: Satellite cell contributions to loading-induced skeletal muscle adaptation. FASEB J. 35, 1–15 (2021).
- Bruusgaard, J. C. et al. No change in myonuclear number during muscle unloading and reloading. J. Appl. Physiol. 113, 290–296 (2012).
À propos de l’auteur
Benjamin Lair
Si vous avez une question concernant notre article, n’hésitez pas à nous en faire part via notre formulaire de contact.
À propos de l’auteur
Benjamin Lair
Si vous avez une question concernant notre article, n’hésitez pas à nous en faire part via notre formulaire de contact.
